Intermitterend vasten was hét populairste dieet in 2020. Sommigen kozen voor de 16:8 of de 5:2 variant en anderen kozen ervoor simpelweg op werkdagen te vasten. In totaal probeerden 17 miljoen mensen in de VS deze nieuwe trend uit. De Instagramaccounts van gewonen mensen en beroemdheden stonden opeens vol met succesverhalen over dit populaire dieet, wat de trend alleen maar vergrootte. Waarschijnlijk weten echter maar weinig van deze mensen wat het begrip ‘autofagie’ inhoudt.
Het je je zelf wel eens afgevraagd wat er tijdens intermitterend vasten in je lichaam gebeurt?
Als je antwoord nee is, raad ik je aan verder te lezen. In dit artikel zal ik je de wetenschap achter autofagie en intermitterend vasten uitleggen, zodat je precies weet wat er tijdens een periode van vasten in je lichaam gebeurt.
Inhoudsopgave
Wat is autofagie?
Autofagie komt van de Griekse woorden ‘auto’ en ‘phagein’. Auto’ betekent ‘zelf‘ en ‘phagein’ betekent ‘eten‘. Als je deze twee woorden combineert betekent autofagie letterlijk ‘zelf-eten’. Het is een vorm van zelf-kannibalisme, maar NIET op een slechte manier. Het is de natuurlijke manier van het lichaam om oude, dode en beschadigde cellen op te ruimen. Door dit te doen, kan het lichaam nieuwe, gezonde cellen produceren en regenereren.
We zijn gewend alles te kunnen eten wat ons hartje begeert
In de ongeveer 2 miljoen jaar van onze evolutie van mensaap naar mens kenden we tijden dat er voedsel in overvloed was. Maar we kenden ook tijden dat voedsel schaars was. Tegenwoordig is er echter altijd een overvloed aan calorieën beschikbaar – in elk geval voor de mensen die in de “ontwikkelde” wereld wonen. In het normale leven doorlopen we dus niet langer de cyclus van overvloed en schaarste, zoals we dat vroeger wel deden. In plaats daarvan bevinden we ons altijd in overvloed-modus.
Het probleem hiermee is dat we zijn geëvolueerd om tijden van overvloed EN schaarste te kennen. Ons lichaam werkt daarom het beste wanneer we aan beiden worden blootgesteld.
- Als we genoeg voedsel hebben, kunnen onze lichaamscellen groeien en zich vermenigvuldigen. Maar wanneer we niet genoeg voedsel hebben, kan het lichaam een metabolische schakelaar (1) omzetten. Hierdoor richt het lichaam zich op het versterken van onze cellen zodat ze beter op stress kunnen reageren.
- De cellen doen dit door oude en defecte celbestanddelen af te breken, ze te vernieuwen en te regenereren en de productie van zaken als antioxidanten te verhogen.
- De afgebroken onderdelen kunnen dan worden gebruikt voor de productie van nieuwe cellulaire componenten of energie.
Voor een goede gezondheid is het belangrijk af en toe iets minder te eten.
Gevolgen van overvloed en schaarste
OVERVLOED: Door te veel te eten kunnen beschadigde eiwitten en andere celonderdelen zich ophopen, waardoor cellen hun werk niet meer goed kunnen doen. Ons lichaam, inclusief onze organen, is opgebouwd uit cellen. Uiteindelijk kan dit ertoe leiden dat cellen belangrijke functies niet meer goed uit kunnen voeren.
SCHAARSTE: Schaarste kan natuurlijk ook problemen veroorzaken. Als we te weinig calorieën binnenkrijgen en ons lichaam veel tijd en energie besteed aan het afbreken van cellen, hebben we geen energie meer over voor andere zaken.
Daarom is het belangrijk dat er een balans is tussen periodes van overvloed en schaarste. Intermitterend vasten stelt ons in staat dit te doen, omdat we periodes van schaarste na kunnen bootsen en dit met periodes van overvloed af kunnen wisselen.
mTOR vs autofagie
De balans tussen overvloed en schaarste speelt zich af in twee tegengestelde cellulaire processen die beide op elk moment in ons lichaam gaande zijn: mTOR en autofagie.
mTOR, Paaseiland en het enzym waar bodybuilders van dromen
De eerste, mTOR, is een groeiproces. mTOR staat voor ‘mechanistic target of rapamycin’.
Het is een bijzondere naam waar een stukje geschiedenis achter zit. mTOR is vernoemd naar een bodembacterie die voor het eerst werd gevonden tijdens een expeditie naar Paaseiland in de jaren zestig van de vorige eeuw. Paaseiland is een eiland in de Stille Oceaan, ongeveer 2000 mijl voor de kust van Chili. Paaseiland staat bekend om zijn Moais, oftewel enorme stenen beelden. De eilandbewoners zelf noemen het eiland ook wel Rapa Nui. De bacterie ‘rapamycine’ werd naar het eiland Rapa Nui vernoemd.
mTOR is niet de bodembacterie. Het is een enzym dat in ons lichaam wordt aangemaakt, maar de bodembacterie rapamycine stimuleert de activiteit van mTOR en staat bekend als het ‘doelwit’ van rapamycine. Als dit enzym wordt gestimuleerd, beginnen cellen te groeien, maken ze eiwitten aan en vermenigvuldigen ze zich sneller. mTOR is daarom belangrijk voor bodybuilders en andere krachtsporters die het zoveel mogelijk proberen te stimuleren.
Autofagie: de wetenschap achter vasten
Het tegenovergestelde proces van mTOR heet autofagie. Tijdens het autofagie-proces worden oude en beschadigde cellen afgebroken. Omdat de twee processen het tegenovergestelde van elkaar zijn, is de autofagie laag wanneer mTOR wordt gestimuleerd en vice versa.
Hoe werkt autofagie precies?
- Bij autofagie vormen cellen speciale structuren die fagoforen worden genoemd.
- Fagoforen zijn membraanstructuren die langzaam groeien tot een balvorm die omgeven is met een membraan.
- Het membraan is gemaakt van een zogenaamde lipide dubbellaag.
- Lipiden zijn op vet gebaseerde moleculen en lipide dubbellagen omgeven alle organellen in onze cellen, plus al onze cellen (alle 20 miljard!).
- Celorganellen vervullen verschillende functies in onze cellen en kunnen een beetje worden voorgesteld als de verschillende organen in ons lichaam.
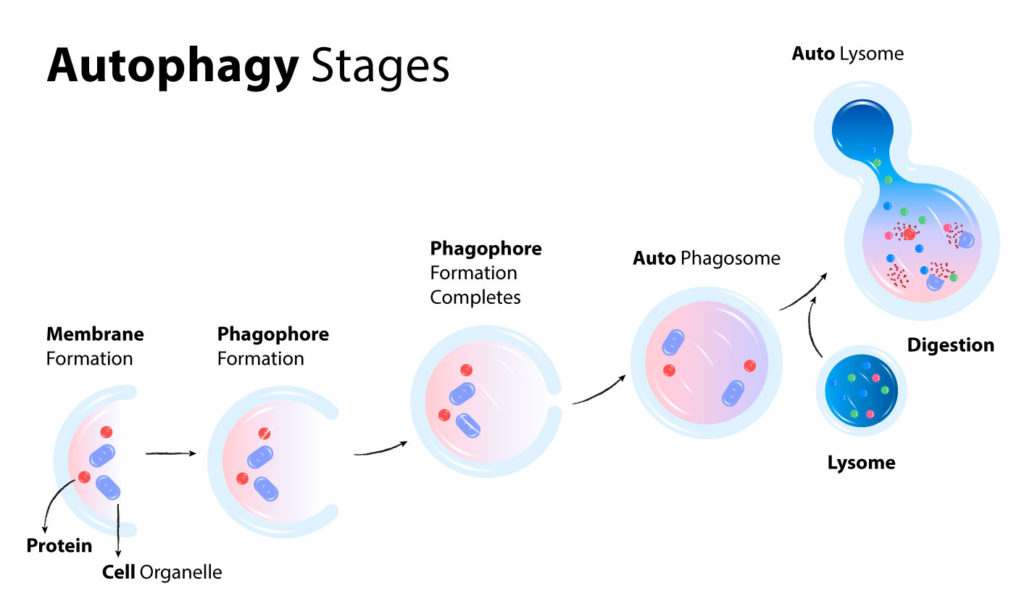
Fagofoorvorming
Terwijl de bal of fagofoor zich volledige vormt, beweegt hij zich door de cel. Hij verzamelt eiwitten en andere organellen die een speciale marker hebben gekregen die de fagofoor vertelt dat zij geselecteerd zijn om te worden afgebroken. Deze speciale marker wordt ubiquitine genoemd.
Voltooiing van de vorming van de fagofoor
De membranen vormen zich volledig rond de eiwitten en organellen. Wanneer dit gebeurt, verandert de naam van de structuur van een fagofoor in een autofagosoom. De autofagosoom beweegt zich vervolgens naar een lysosoom en versmelt ermee. Een lysosoom is een organel dat kan worden gezien als de maag van de cel, hoewel je dat niet te letterlijk moet nemen, want een cel bevat vele lysosomen!
Net als in onze maag is de inhoud van lysosomen zuur en bevat het verteringsenzymen die eiwitten en organellen afbreken. Als ze eenmaal afgebroken zijn tot afzonderlijke aminozuren kunnen ze opnieuw worden gebruikt voor de opbouw van nieuwe eiwitten, organellen en zelfs nieuwe cellen. Ze kunnen ook door de lever worden gebruikt om energie te produceren in een proces dat bekend staat als gluconeogenese. De aminozuren die worden gebruikt voor nieuwe cellen en eiwitten worden gestimuleerd door het mTOR-enzym. Op deze manier voltooid de cyclus zich vanzelf wanneer het lichaam schakelt tussen autofagie en mTOR.

Er is ook een vorm van autofagie die zich specifiek op onze mitochondriën richt. De selectieve afbraak van mitochondriën gebeurt via een proces dat mitofagie wordt genoemd. Mitochondriën, ook organellen, zijn de motoren van onze cellen en produceren energie. Elke cel in ons lichaam bevat wel 2000 mitochondriën of meer.
Maar omdat we zuurstof gebruiken om energie te produceren en zuurstof oxidatieve stress veroorzaakt, hebben onze mitochondriën voortdurend te maken met vrije radicalen. Dit betekent dat ze zeer gevoelig zijn voor beschadiging. Daarom is het proces van mitofagie waarin beschadigde mitochondriën afgebroken en hersteld worden een essentieel proces voor het lichaam.
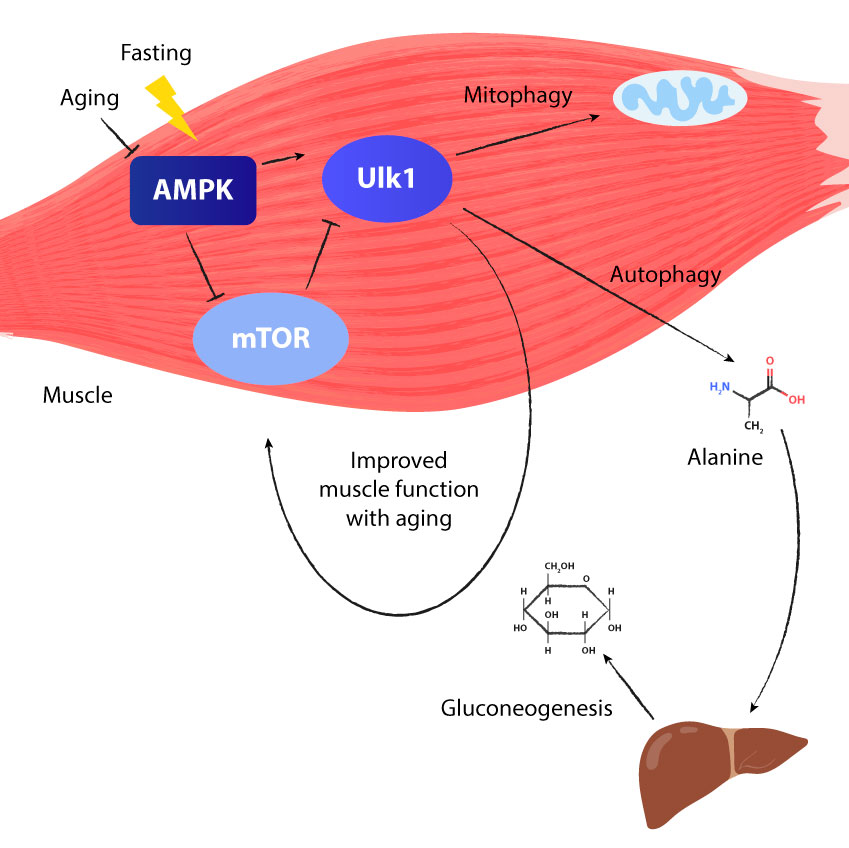
Zo stimuleert vasten autofagie en mitofagie
Als we vasten komt er minder energie via voedsel ons lichaam binnen. Dit leidt tot een lichte verstoring van de energiebalans, omdat er meer energie wordt verbruikt dan geproduceerd. Een speciaal enzym in het lichaam houdt deze energiebalans voortdurend in de gaten; dit enzym heet AMPK (adenosine monofosfaat-activated proteïne kinase).
Het doet dit door de AMP-tot-ATP verhouding in de gaten te houden.
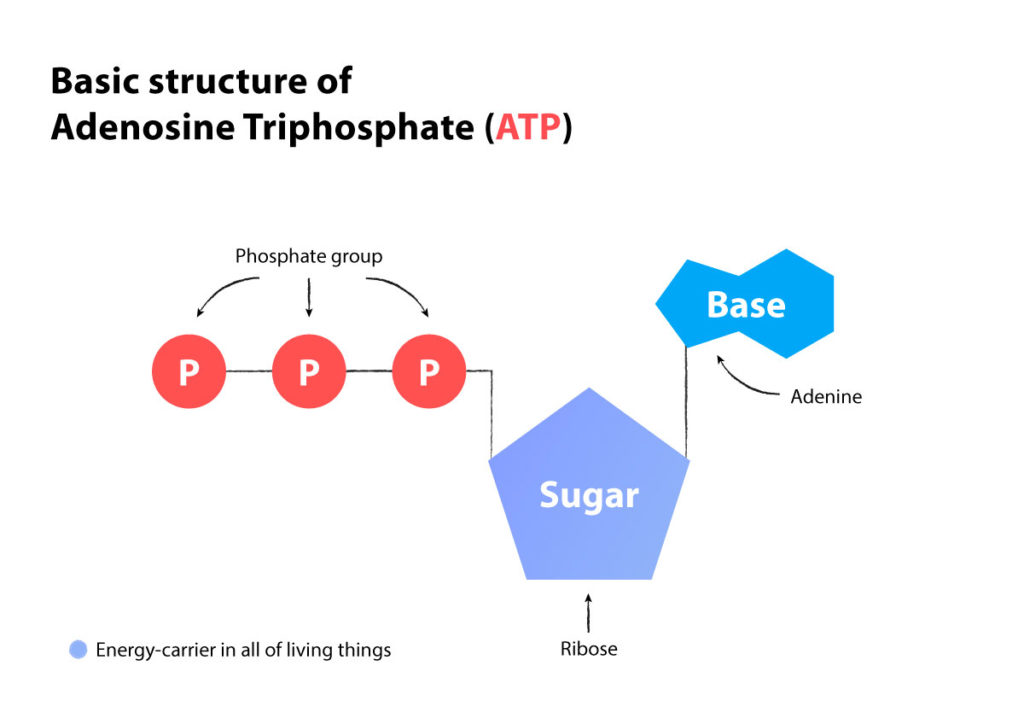
Er komt energie vrij wanneer ATP een fosfaatmolecuul afgeeft en tot ADP wordt afgebroken. Wanneer er weinig energie is, worden 2 ADP’s samengevoegd om een ATP te maken, waardoor een AMP overblijft. (ATP is een adenosinemolecuul met 3 fosfaten, ADP is een adenosinemolecuul met 2 fosfaten en AMP is een adenosinemolecuul met 1 fosfaatverbinding).
ATP = denosinetrifosfaat (3 fosfaten)
ADP = adenosinedifosfaa (2 fosfaten)
AMP = Adenosinemonofosfaat (1 fosfaat)
Wanneer 2 ADP’s samenkomen (2 fosfaten + 2 fosfaten), wordt er een ATP (3 fosfaten) en een AMP (1 fosfaat) geproduceerd.
Als de verhouding van AMP ten opzichte van ATP toeneemt, betekent dit dat er minder energie beschikbaar is en wordt AMPK gestimuleerd. Wanneer AMPK wordt gestimuleerd, stimuleert dit het ULK1 eiwit, wat de productie van de membranen die de fagofoor vormen in gang zet.
NAD+ en de sirtuïnes
Vasten verhoogt ook het niveau van NAD+, de geoxideerde vorm van NADH. Dit is een actieve vorm van vitamine B3 (essentieel voor de energieproductie).
Sirtuïne is de naam van een groep eiwitten die autofagie direct stimuleren
Meer productie van energie in de mitochondriën betekent dat er meer NADH in NAD+ omgezet wordt. Deze toename van de verhouding NAD+ tot NADH stimuleert de productie van de sirtuïnes.
De sirtuïnes zijn eiwitten die autofagie rechtstreeks stimuleren. Hun productie wordt onder andere geassocieerd met een langere levensduur en een bevordering van het DNA-herstel (2).
Zowel AMPK als de sirtuïnes activeren ook andere genen waarvan bekend is dat ze veel voordelen voor de gezondheid hebben, waaronder FOX-genen, TFEB, PGC-1a en P53.
- Activering van de FOX-genen wordt in verband gebracht met een verhoogde stressbestendigheid, een langere levensduur en minder tumoren. Dit komt omdat disfunctionele cellen worden aangezet tot cellulaire zelfmoord (apoptose) in plaats van te blijven groeien waardoor ze mogelijk tumoren kunnen worden (3).
- TFEB is de belangrijkste stimulator van de productie van nieuwe lysosomen en is dus rechtstreeks betrokken bij autofagie.
- P53 staat bekend als de “bewaker van het genoom”, omdat het DNA-mutaties voorkomt (4) en de vorming van tumoren onderdrukt (5).
- PGC-1a is het belangrijkste gen dat betrokken is bij het stimuleren van de aanmaak van nieuwe mitochondriën. Hoe meer mitochondriën we hebben, hoe minder druk er op onze bestaande mitochondriën staat om de energie te produceren die we nodig hebben. Dit maakt onze energieproductie efficiënter. En hoe efficiënter onze energieproductie is, hoe minder vrije radicalen er worden geproduceerd.
De rol van ketose in autofagie
Intermitterend vasten leidt ook tot een afbraak van vetweefsel, waardoor een grotere hoeveelheid vrije vetzuren de lever bereikt. Hierdoor neemt de productie van ketonen toe (1).
Ketonen zijn op vet gebaseerde moleculen die energie kunnen produceren.
Ketonen zijn op vet gebaseerde moleculen die zeer efficiënt energie kunnen produceren. De verbranding van ketonen voor energie produceert minder vrije radicalen en vermindert ontstekingen. Ketonen stimuleren ook de productie van BDNF (brain-derived neurotrophic factor). BDNF is een groeihormoon voor de hersenen en stimuleert de groei van nieuwe hersencellen (neuronen). Daarnaast bevordert het de ontwikkeling van nieuwe synapsen, de verbindingen tussen neuronen (1). Hoe meer verbindingen of synapsen we hebben, hoe meer we kunnen leren en begrijpen.
Waarom is intermitterend vasten zo populair in 2021?
Welke gezondheidsvoordelen brengt intermitterend vasten ons:
Gewichtsverlies
Veel mensen besluiten een vorm van vasten te proberen omdat ze graag af willen vallen. Studies hebben aangetoond dat proefpersonen gemiddeld tussen 2,5% en 9,9% van hun lichaamsgewicht verliezen gedurende de periode van 3-6 maanden dat studies naar vasten lopen (7, 8). Er is ook aangetoond dat dit gewichtsverlies afkomstig is van vetmassa in plaats van spiermassa.
Intermitterend vasten kan helpen bij het reguleren van de glucose- en insulinespiegel
Het is ook aangetoond dat intermitterend vasten de glucose- en insulinespiegel verlaagt bij diabetici (10), mensen met obesitas (7) en mensen zonder obesitas (11). Bovendien werd in een studie bij jonge vrouwen met overgewicht een verlaging van het totale en LDL-cholesterol, de triglyceriden en de bloeddruk gevonden. Onderzoekers vonden ook een verlaging van het C-reactief proteïne, een ontstekingsmarker, en het hormoon leptine dat gewoonlijk hoger is bij mensen met obesitas.
Intermitterend vasten helpt bij de regulatie van testosteron
Wetenschappers vonden ook een toename van het SHBG-proteïne (sex hormone-binding globulin) dat helpt om de effecten van testosteron te verminderen. Vooral wanneer de testeronspiegel van vrouwen te hoog is, kan dit ongewenste neveneffecten hebben (12).
Intermitterend vasten kan zelfs verjongende effecten hebben
De meeste studies naar intermitterend vasten en veroudering zijn uitgevoerd op dieren. De reden daarvoor is simpel – het is moeilijk om deze studies een leven lang op mensen uit te voeren terwijl ze continu intermitterend blijven vasten.
Stimulatie van AMPK en de sirtuïnes tijdens intermitterend vasten wordt echter sterk geassocieerd met een langere levensduur bij dieren.
Studies hebben aangetoond dat intermitterend vasten de levensduur van muizen en apen verlengt en de kans verkleint dat zij ziekten ontwikkelen die met veroudering geassocieerd worden (13). Een studie bij muizen toonde ook aan dat de muizen die vastten minder spiermassa verloren muizen die niet vastten (9).
Conclusie: is het stimuleren van autofagie met intermitterend vasten een goed idee?
Intermitterend vasten kan een aantal zeer positieve gezondheidsvoordelen hebben:
- Het kan autofagie stimuleren.
- Het wordt geassocieerd met een langere levensduur.
- Het kan de productie van nieuwe mitochondriën stimuleren.
- Het kan ontsteking verminderen en de cardiovasculaire gezondheid verbeteren.
- Het helpt mensen gewicht te verliezen.
- En het kan helpen bij het verlagen van een te hoge testosteronspiegel bij vrouwen.
Maar hoewel dit prachtige voordelen zijn, heb ik één potentieel probleem met vasten nog niet genoemd. En dat is dat we er zeker van moeten zijn dat we echt vasten en onszelf niet gewoon uithongeren.
Als je op de juiste manier vast, zou het geen slechte bijwerkingen zoals duizeligheid, zwakte, irritatie of andere negatieve gevoelens moeten veroorzaken.
Het is niet erg om je een beetje hongerig te voelen. Maar als je je slecht voelt of het nauwelijks tot je volgende eetmoment kunt uithouden, zit je lichaam in de zogenaamde ‘hongermodus’.
Ons lichaam gaat in de hongermodus wanneer we niet genoeg ketonen produceren om onze hersenen van brandstof te voorzien. En omdat er via onze voedselinname niet genoeg energie binnenkomt, nemen onze hersenen een gevaarlijk voedseltekort waar. Ze zullen er dan alles aan laten doen om energie te besparen. Een van die manieren is door ons belabberd te laten voelen, waardoor we met onze activiteiten stoppen.
Ik heb een gedetailleerde gids geschreven over hoe je deze hongerreactie kunt vermijden. Ik raad je aan deze goed door te lezen voordat je met vasten begint.
Met de juiste informatie en een goed inzicht in hoe intermitterend vasten werkt, kunnen de meesten van ons het echter tot een succes maken en van alle potentiële gezondheidsvoordelen genieten!
Referenties
(1) Stephen D. Anton, Keelin Moehl, William T. Donahoo, Krisztina Marosi, Stephanie Lee, Arch G. Mainous, III, Christiaan Leeuwenburgh, and Mark P. Mattson, Flipping the Metabolic Switch: Understanding and Applying Health Benefits of Fasting, Obesity (Silver Spring). 2018 Feb; 26(2): 254–268.
(2) Uribarri J, Woodruff S, Goodman S, Cai W, Chen X, Pyzik R, et al. Advanced glycation end products in foods and a practical guide to their reduction in the diet. J Am Diet Assoc. 2010;110: 911–916
(3) Eric L Greer & Anne Brunet, FOXO transcription factors at the interface between longevity and tumor suppression, Oncogene volume 24, pages7410–7425(2005)
(4) Read AP, Strachan T (1999). “Chapter 18: Cancer Genetics”. Human molecular genetics 2. New York: Wiley.
(5) Surget S, Khoury MP, Bourdon JC (December 2013). “Uncovering the role of p53 splice variants in human malignancy: a clinical perspective”. OncoTargets and Therapy. 7: 57–68.
(6) Sanchis-Gomar F, García-Giménez JL, Gómez-Cabrera MC, Pallardó FV (2014). “Mitochondrial biogenesis in health and disease. Molecular and therapeutic approaches”. Curr. Pharm. Des. 20 (35): 5619–5633.
(7) Heilbronn LK, Smith SR, Martin CK, Anton SD, Ravussin E. Alternate-day fasting in nonobese subjects: effects on body weight, body composition, and energy metabolism. Am J Clin Nutr [Internet] 2005;81:69–73.
(8) Byrne NMM, Sainsbury A, King NAA, Hills APP, Wood REE. Intermittent energy restriction improves weight loss efficiency in obese men: the MATADOR study. Int J Obes [Internet] 2017:1–10.
(9) Van Norren K, Rusli F, Van Dijk M, Lute C, Nagel J, Dijk FJ, Dwarkasing J, Boekschoten MV, Luiking Y, Witkamp RF, Müller M, Steegenga WT, Behavioural changes are a major contributing factor in the reduction of sarcopenia in caloric-restricted ageing mice.
J Cachexia Sarcopenia Muscle. 2015 Sep; 6(3):253-68.
(10) Deng X, Cheng J, Zhang Y, Li N, Chen L. Effects of caloric restriction on SIRT1 expression and apoptosis of islet beta cells in type 2 diabetic rats. Acta Diabetol. 2010;47(suppl 1):177–85.
(11) M’guil M, Ragala MA, El Guessabi L, Fellat S, Chraibi A, Chabraoui L, et al. Is Ramadan fasting safe in type 2 diabetic patients in view of the lack of significant effect of fasting on clinical and biochemical parameters, blood pressure, and glycemic control ? Clin Exp Hypertens. 2008;30:339–57.
(12) Harvie MN, Pegington M, Mattson MP, Frystyk J, Dillon B, Evans G, et al. The effects of intermittent or continuous energy restriction on weight loss and metabolic disease risk markers: A randomized trial in young overweight women. Int J Obes. 2011;35:714–27.
(13) Beneficial effects of intermittent fasting and caloric restriction on the cardiovascular and cerebrovascular systems. Mattson MP, Wan RJ, Nutr Biochem. 2005 Mar; 16(3):129-37.

